![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
16 Cards in this Set
- Front
- Back
|
Unidades básicas que estructuran a las proteínas |
Los aminoácidos son las estructuras básicas que conforman a las proteínas. |
|
|
Grupos químicos característicos de los aminoácidos |
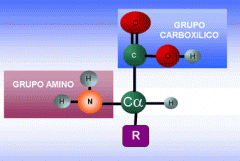
Los aminoácidos poseen un grupo amino (-NH2) y un grupo carboxilo (-COOH) |
|
|
Nombres de los 20 aminoácidos que conforman a las proteínas |
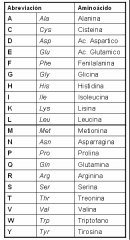
1. Alanina 2. Cisteína 3. Ácido aspártico 4. Ácido glutámico 5. Fenilalanina 6. Glicina 7. Histidina 8. Isoleucina 9. Lisina 10. Leucina 11. Metionina 12. Asparragina 13. Prolina 14. Glutamina 15. Arginina 16. Serina 17. Treonina 18. Valina 19. Triptófano 20. Tirosina |
|
|
Distinción entre las formas D y L de los aminoácidos |
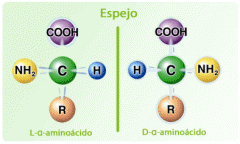
En los aminoácidos del cuerpo humano, solamente existe la forma L y se refiere a la ubicación espacial del grupo amino.
Mnemotecnia : L de Left (izquierdo) y D de Derecho. |
|
|
Clasificación de los aminoácidos de acuerdo a la naturaleza química de sus radicales |

|
|
|
Comportamiento electroquímico de los aminoácidos |
Los aminoácidos pueden tener carga positiva, negativa o neutra, dependiendo de la naturaleza de sus radicales, así como del pH del medio. |
|
|
Concepto de pK de los grupos carboxilo y amino de los aminoácidos |
El pK se define como el logaritmo negativo de la constante de disociación para un ácido débil. Existe un pK para cada grupo funcional, y se denominan pK 1 y pK 2, aunque algunos aminoácidos pueden tener un pK 3. |
|
|
Enlace peptídico como responsable de la unión de los aminoácidos entre sí |
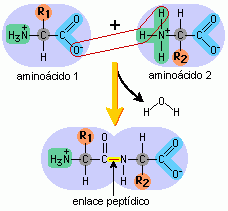
Dos moléculas se unen mediante un enlace covalente, con la pérdida de una molécula de agua. |
|
|
Grupos químicos involucrados en la formación de enlaces peptídicos |
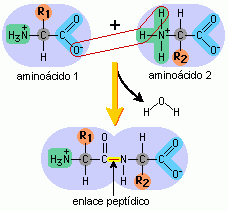
El grupo carboxilo del primer aminoácido se une con el grupo amino del segundo aminoácido. |
|
|
Tipo de enlace que corresponde al enlace peptídico |
Enlace covalente. |
|
|
Concepto de macromolécula |
Son moléculas con una masa atómica superior a los 10'000 daltons (Da). |
|
|
Concepto y ejemplos de proteínas globulares y fibrilares |
Las proteínas globulares doblan sus cadenas en una forma esférica, con los grupos hidrófobos en el interior y los grupos hidrófilos al exterior. Ejemplos : Albúmina, globulinas.
Las proteínas fibrilares presentan cadenas polipeptídicas largas. Ejemplos : Queratina, colágeno, elastina. |
|
|
Estructura tridimensional de las proteínas globulares, destacando las estructuras primaria, secundaria, terciaria y cuaternaria, así como los enlaces que las estabilizan |
1. Estructura primaria : Es la secuencia de aminoácidos de la cadena proteica y el orden en que están enlazados, mediante enlaces peptídicos.
2. Estructura secundaria : Es el plegamiento que la cadena polipeptídica adopta en el espacio, gracias a la formación de puentes de hidrógeno entre los grupos CO y NH del enlace peptídico.
3. Estructura terciaria : Es la disposición tridimensional que adoptan todas las cadenas que conforman a la proteína. Se unen mediante enlaces covalentes (puentes disulfuro y enlaces amida) y no covalentes (fuerzas electrostáticas, puentes de hidrógeno, etc).
4. Estructura cuaternaria : Es la unión de los diferentes cadenas polipeptídicas. Los enlaces en su mayoría son no covalentes. |
|
|
Funciones que realizan las proteínas globulares |
Enzimas, mensajeros, transporte, defensa. |
|
|
Proteínas chaperonas y su relevancia en la conformación de proteínas |
Son proteínas que participan en el plegado de más de la mitad de las proteínas de los mamíferos. Evitan la agregación y se aseguran del correcto plegamiento estructural de la proteína. |
|
|
Perturbación de la conformación de las proteínas globulares y sus consecuencias, con algunos ejemplos. |
Un mal plegamiento de las proteínas, induce su malformación y su agregación, alterando las funciones de la proteína.
Ejemplos : Enfermedad por prión, enfermedad de Alzheimer, B-Talasemias, |

